肝炎ウイルス検査報告書の表記変更のお知らせ
謹啓 時下ますますご清栄のこととお喜び申し上げます。
平素は格別のご高配を賜り厚くお礼申し上げます。
12月6日配布のインフォメーションNO.2016-51「検査内容変更のお知らせ」で、ご案内致しましたが、「肝炎ウイルス検査報告書」の表記変更について、下記のとおり、改めてお知らせいたします。
何卒ご理解の程、よろしくお願い申し上げます。
敬白
記
■実施日 平成29年 1月 5日(木) ご依頼分より
■変更内容 肝炎ウイルス検査報告書の表記内容
変更内容の詳細については裏面をご覧ください。
■変更理由 肝炎ウイルス検査項目の変更および掲載項目の一部見直しのため
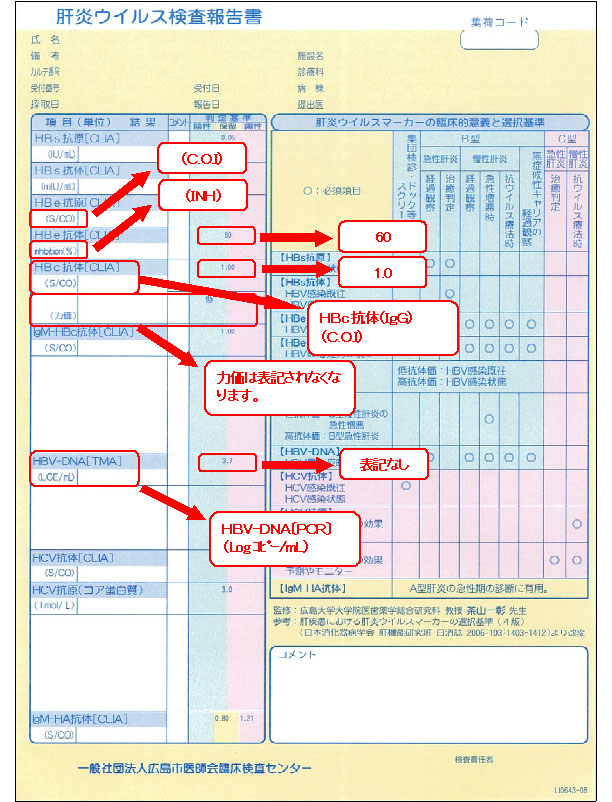
肝炎ウイルス検査報告書の表記内容
肝炎ウイルス検査項目の変更に伴い、肝炎ウイルス検査報告書の表記内容が一部、以下のとおり変更になります。HBc抗体〔CLIA〕については、これまで力価が表記されていましたが、今後は表記されませんので、ご了承ください。また、これと合わせ、HBV-DNA〔TMA〕に代わり、HBV-DNA〔PCR〕を掲載いたします。なお、HBV-DNA〔PCR〕は、基準範囲が「検出せず」のため、判定基準のプロットは表示できませんのでご了承願います。