検査内容変更のお知らせ
謹啓 時下ますますご清栄のこととお喜び申し上げます。
平素は格別のご高配を賜り厚くお礼申し上げます。
このたび、下記の検査項目について、検査内容を変更させていただきたくご案内いたします。
何卒ご了承賜りますよう、よろしくお願い申し上げます。
敬白
記
■実施日 平成29年 1月 5日(木) ご依頼分より
■変更項目
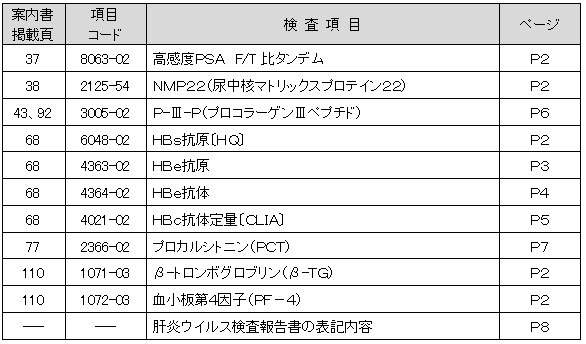
詳細については以下をご覧ください。
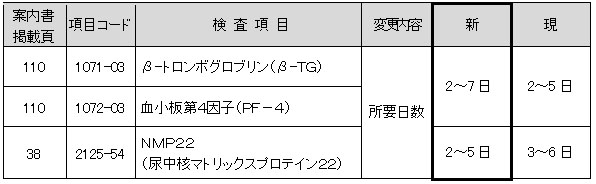
β-トロンボグロブリン(β-TG)、血小板第4因子(PF-4)、NMP22(尿中核マトリックスプロテイン22)
下記項目におきまして、所要日数を変更させていただきます。
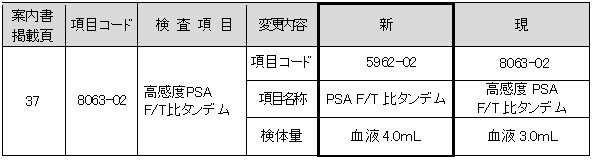
高感度PSA F/T比タンデム
試薬変更に伴い、検査方法が変更となります。なお、基準範囲の変更はありません。
HBs抗原〔HQ〕
試薬変更に伴い、基準範囲が変更となります。

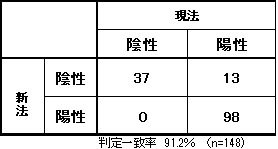
HBe抗原
試薬変更に伴い、検査方法、単位が変更となります。なお、基準範囲は変更ありません。
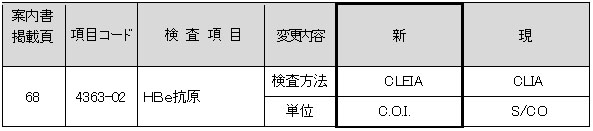
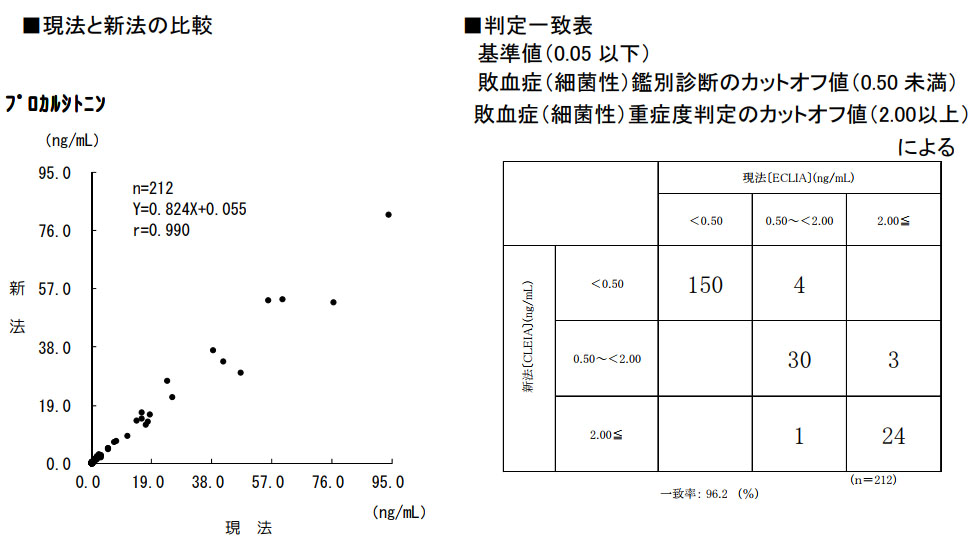
■現法と新法の比較
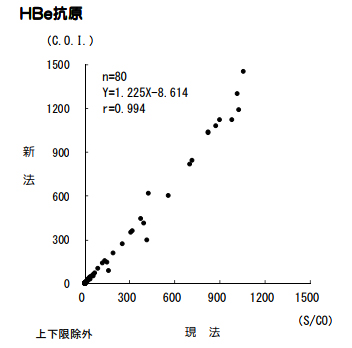
■現法と新法の比較
HBe抗体
試薬変更に伴い、検査方法、基準範囲、単位が変更となります。
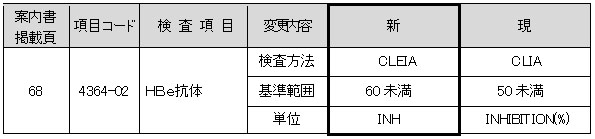
■現法と新法の比較

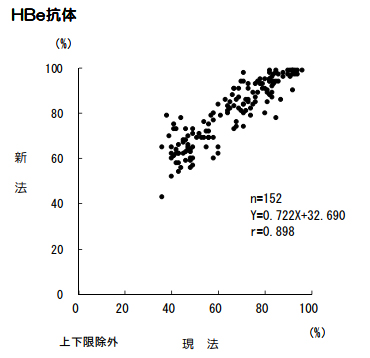
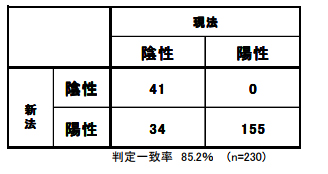
■判定一致表

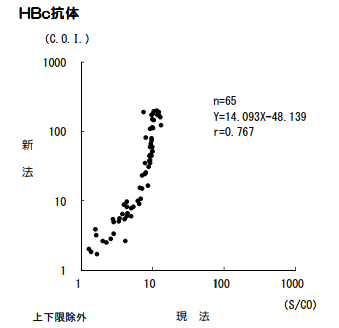
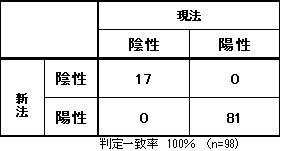
HBc抗体定量〔CLIA〕
試薬変更に伴い、検査方法、基準範囲、単位が変更となります。
新試薬は、IgG型のHBc抗体を測定対象としております。
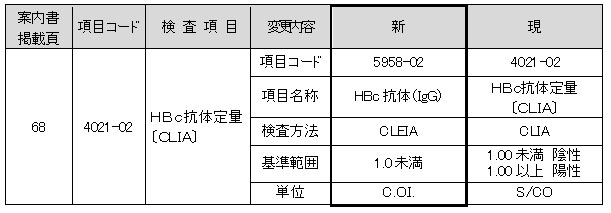
■現法と新法の比較
■判定一致表
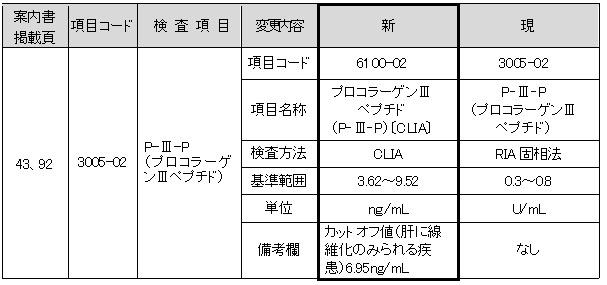
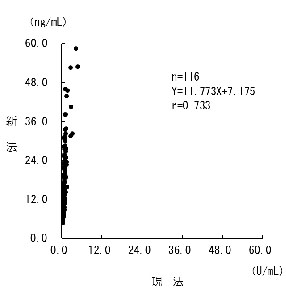
P-Ⅲ-P(プロコラーゲンⅢペプチド)
Non-RIA試薬へ変更いたします。変更に伴い、検査方法、基準範囲、単位が変更となります。基準範囲は文献値です。カットオフ値については、備考欄をご参照ください。
■現法と新法の比較
検査方法・単位等が異なるため相関性はありませんのでご留意ください。
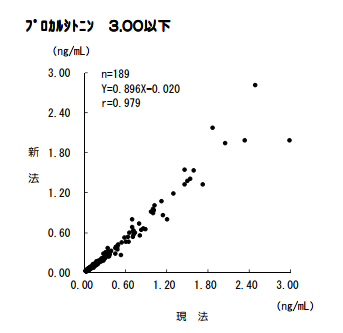
プロカルシトニン(PCT)
試薬変更に伴い、検査方法が変更となります。なお、基準範囲の変更はありません。

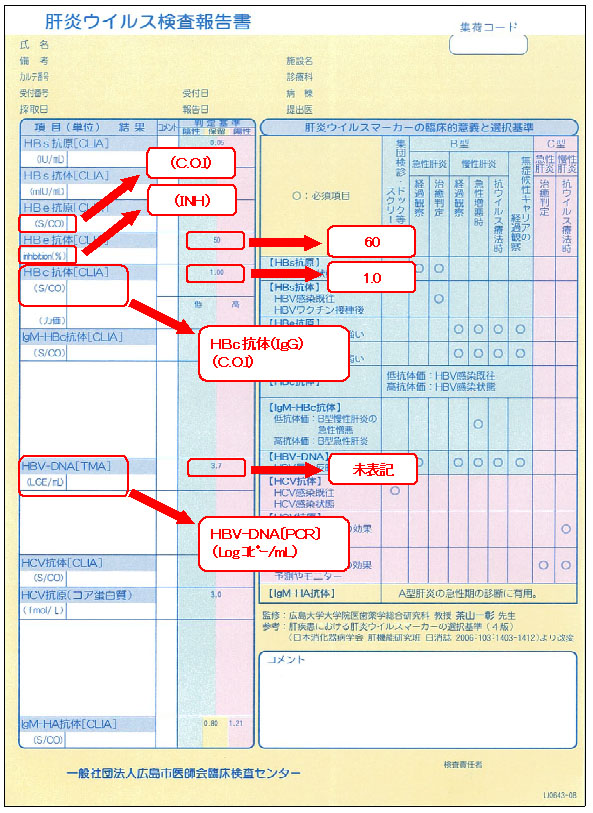
肝炎ウイルス検査報告書の表記内容
このたびの肝炎ウイルス検査項目の変更に伴い、肝炎ウイルス検査報告書の表記内容が一部変更となります。また、これに合わせ、HBV-DNA〔TMA〕に代わり、HBV-DNA〔PCR〕を掲載させていただきます。なお、HBV-DNA〔PCR〕は、基準範囲が「検出せず」のため、判定基準のプロットは表示できませんのでご了承ください。